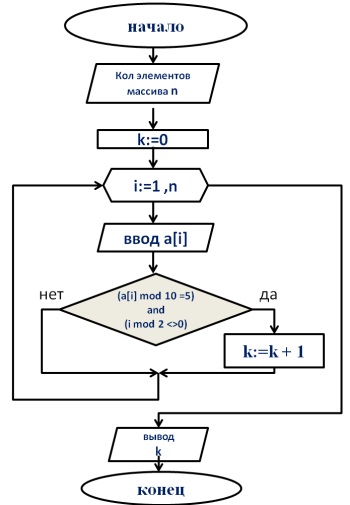
Как определить отношение масс элементов

Отношение масс элементов в веществе. Массовые доли элементов в веществе
Относительная молекулярная масса. Количество вещества. Число Авогадро Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с учётом числа атомов каждого элемента в формульной единице сложного вещества. Атомы и молекулы - частицы чрезвычайно малые, поэтому порции веществ, которые берутся для химических реакций, характеризуются физическими величинами, соответствующими большому числу частиц. Молярную массу вещества В можно определить как отношение массы данной порции вещества m В к количеству вещества n В в этой порции:. Закон Авогадро.




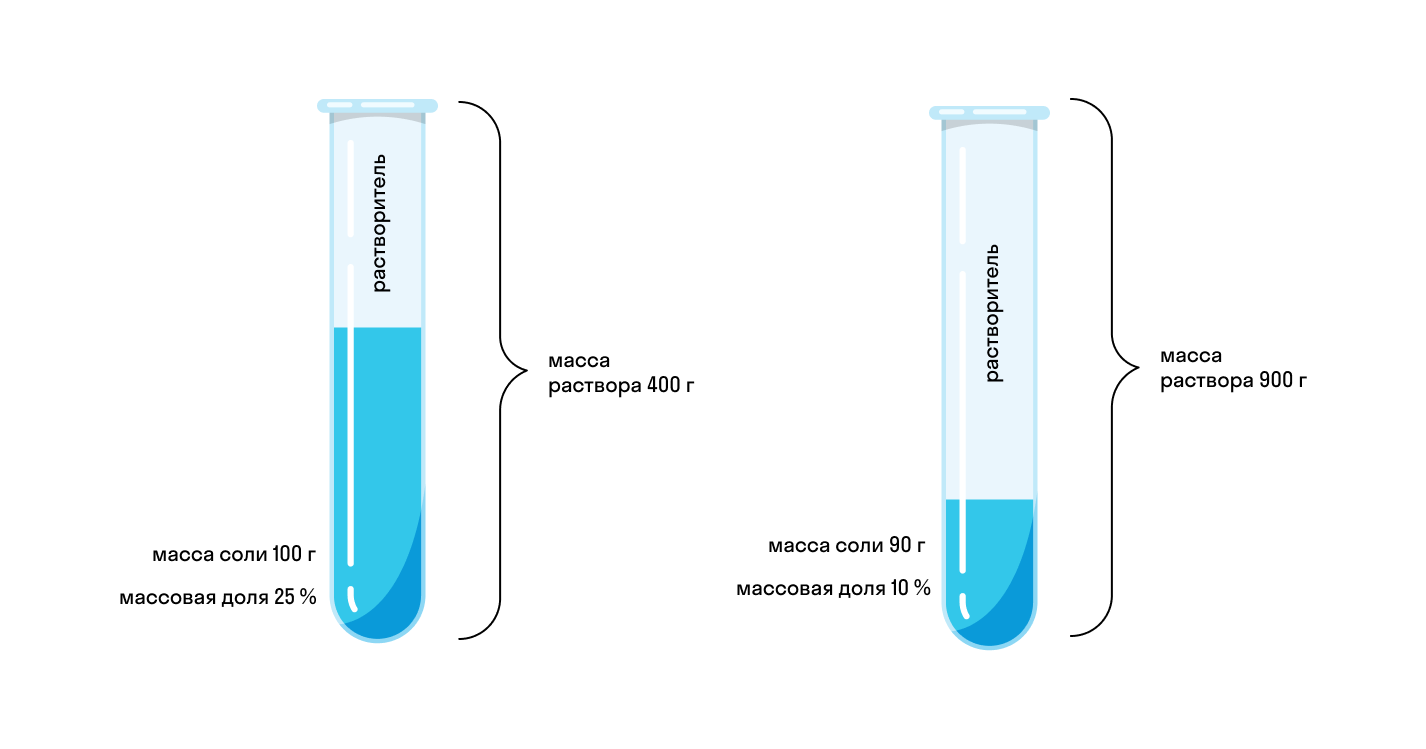



В химии массовое отношение, часто называемое «процентным составом по массе», представляет собой долю конкретной молекулы, которая состоит из составляющих ее элементов. Этот принцип порождает закон постоянного состава, выдвинутый Джозефом Прустом в году: данное соединение всегда имеет одинаковую пропорцию по массе составляющих его элементов. Например, вода всегда имеет ровно 8 грамм кислорода на каждый грамм водорода. Углекислый газ всегда содержит 2,67 г кислорода на каждый грамм углерода.










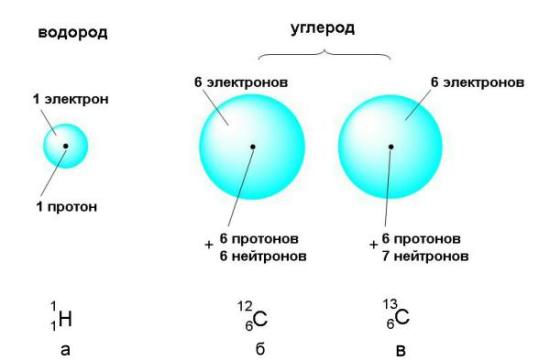
В уроке 2 « Относительная атомная масса химических элементов » из курса « Химия для чайников » рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается. Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.